 2025-08-15
2025-08-15
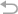 返回列表
返回列表
阿尔茨海默病(AD)的治疗,一直困在一道天然屏障——血脑屏障(BBB)面前。这道“城墙”固然保护大脑免受外界有害物质侵袭,但也挡住了许多本可改善病情的药物。
近日,美国南旧金山的 Denali Therapeutics 与麻省 Biogen 联合研究团队,在《Science》发表了重磅成果。这次,他们的目标是解决一个长期悬而未决的难题:如何让抗淀粉样蛋白(Aβ)抗体既能高效穿过BBB进入大脑,又能避免治疗中最令人担心的副作用——淀粉样相关影像学异常(ARIA)。
淀粉样蛋白假说:AD患者脑内的Aβ斑块被认为是神经退行性变化的重要驱动力。清除这些斑块,可能延缓疾病进程。
现有抗Aβ抗体问题:虽然部分药物已获批,但它们通过BBB的效率极低,且容易引发 ARIA(淀粉样相关影像学异常)——表现为脑水肿或微出血,可能迫使医生减量或停药。
原因之一:常规抗体进入大脑的主要通道是脑脊液和动脉周围空间,这些区域往往正是血管淀粉样沉积(CAA)的聚集地,容易引发炎症反应。
研究团队瞄准了转铁蛋白受体(TfR)——一种在大脑毛细血管内皮细胞上高表达的蛋白。通过受体介导转运,TfR可以把结合的分子直接送过BBB。
他们设计了一种抗体运输载体(ATVcisLALA),在抗体Fc段引入非对称性LALA突变:
这样的抗体就像拿着“VIP通行证”的快递员,可以通过毛细血管安全快速进入大脑深处,并避开高风险的CAA区域。
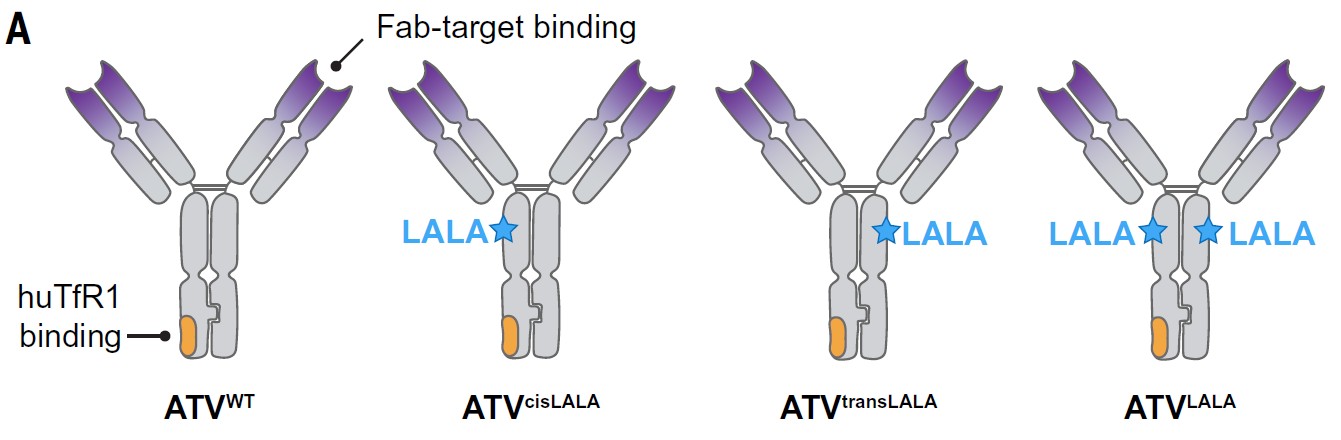
图1. “非对称”LALA突变:既减少TfR相关副作用,又保留抗体清除功能 (A) ATV抗体的结构示意图,标出是否含有L234A/L235A(LALA)突变。结果显示:ATV的非对称LALA设计能显著降低与TfR结合时的免疫副作用,但仍保留针对靶标的杀伤功能。(原图Fig.1)
这项研究不仅在分子设计上有创新,在成像技术的运用上也堪称亮点。研究团队利用组织切片扫描/分析+共聚焦+组织透明化(iDISCO)+ 三维光片显微成像,将处理后的整个小鼠半脑进行高分辨率成像,直观呈现了抗体在脑内的分布轨迹。
成像结果清晰地显示:
这种可视化证据为药物作用机制提供了直接而有力的支持,也让科研人员能够定量分析抗体在不同脑区的分布差异。
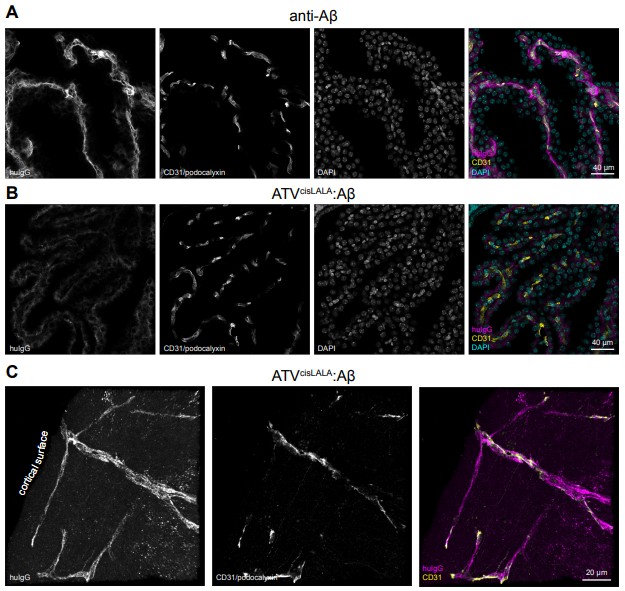
图2. 共聚焦显微成像: 在TfRmu/hu KI 小鼠单次静脉注射抗Aβ 抗体(A)或 ATVcisLALA:Aβ(B) 24 小时后,检测 huIgG 信号与血管标记(CD31)及DAPI的分布情况。(C) 在皮层中,huIgG 信号与 CD31 阳性的脑内皮细胞共定位,表明其通过血管内皮的 TfR 介导转运进入脑内。
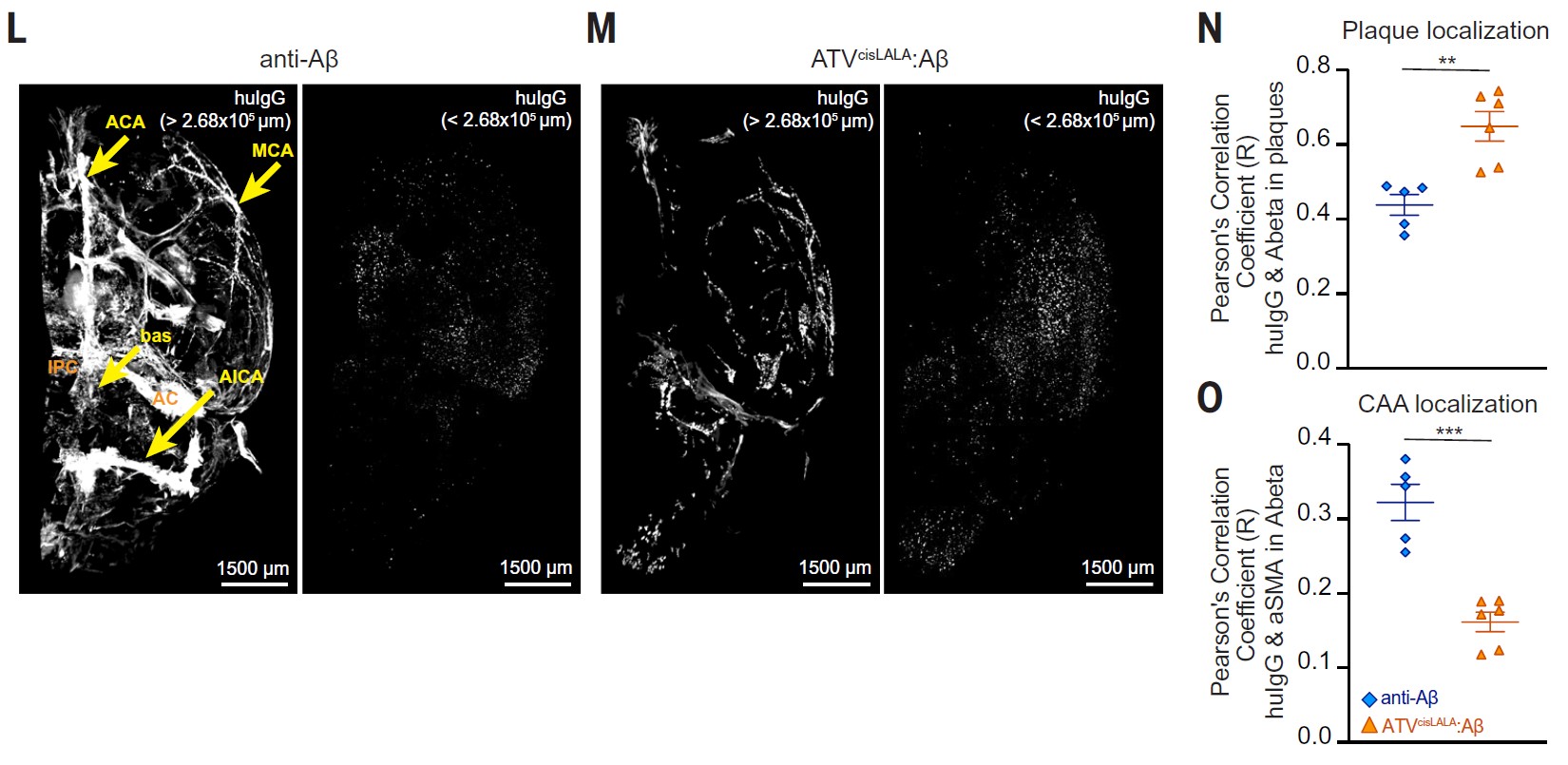
图3. 3D whole-brain imaging 实验(iDISCO组织透明化 + 光片成像)显示ATVcisLALA:Aβ 在脑内具有更优的分布、更强的靶点结合能力,并且与动脉的关联更少。
在这里,如果你也有类似文章中的成像需求,不妨联系我们:
南京星智云开
联系我们
其包括了组织切片扫描、共聚焦成像、三维重构及组织透明化处理等服务和全流程技术支持:
这项研究不仅解决了如何更高效将抗体送入大脑的问题,还在安全性上取得了重要突破。通过改变进入大脑的路径,ATVcisLALA有效避开了动脉周围的淀粉样沉积区,从源头上降低了ARIA风险。
更重要的是,这种TfR介导的递送策略并不局限于抗Aβ抗体。理论上,它可以扩展到其他针对中枢神经系统疾病的大分子药物——帕金森病、亨廷顿舞蹈症,甚至某些脑肿瘤治疗,都可能受益。
然而,目前的证据仍停留在动物实验阶段。未来的临床试验需要验证:
如果这些问题得到肯定回答,ATVcisLALA或类似策略有望改变阿尔茨海默病免疫疗法的格局,让更多患者安全受益。
参考来源:
Pizzo, M. E., et al. Transferrin receptor–targeted anti-amyloid antibody enhances brain delivery and mitigates ARIA.Science, 389, eads3204 (2025). DOI: 10.1126/science.ads3204