 2025-09-10
2025-09-10
 返回列表
返回列表
胶质母细胞瘤(Glioblastoma, GBM)是最具侵袭性的原发性脑肿瘤之一,预后极差。当前标准治疗主要依赖放化疗及 DNA 烷化剂替莫唑胺(TMZ),但其对患者的总体生存期仅有有限延长,大多数患者仍在诊断后 15 个月内死亡。导致治疗失败的关键因素包括:血脑屏障(BBB)限制药物进入、胶质母细胞瘤干细胞(GSCs)的耐药性、以及缺乏能有效预测临床疗效的患者模型。因此,探索新的药物作用机制,尤其是与神经生理相关的脆弱性,成为突破 GBM 治疗困境的重要方向。
本文采用了一种名为 pharmacoscopy (PCY) 的高内涵成像药物筛选平台,对 27 位 IDH 野生型胶质母细胞瘤患者的新鲜手术标本进行了系统性药物测试。研究团队建立了一个 包含 132 种药物的筛选体系,涵盖传统肿瘤药物和已上市的神经活性药物(neuroactive drugs, NADs),并在单细胞水平上评估其对肿瘤细胞及肿瘤微环境细胞的选择性杀伤作用。
研究不仅依赖体外实验,还结合了:
在这项研究中,研究团队采用了 pharmacoscopy (PCY) 平台,这是一种基于高内涵成像的外植体药物筛选方法,能够在单细胞分辨率水平上评估药物对胶质母细胞瘤(GBM)及肿瘤微环境中不同细胞群的作用。
在实验过程中,肿瘤样本被解离并接种至 384 孔板中,经药物处理后进行免疫荧光(IF)标记。随后通过共聚焦显微镜获取图像,利用 DAPI 染色对细胞核进行分割,再通过 CellProfiler 软件扩展到胞质区域,识别并定量多种标记物表达情况。研究人员根据 Nestin 和 S100B 识别肿瘤细胞,以 CD45 标记免疫细胞,其余未标记群体被归为 “other” 类细胞。
下游图像分析由 MATLAB 完成,计算每个样本中不同群体的比例。核心指标为 PCY score,其公式为:
PCY score = 1 − {[TPDRUG] ÷ [TPDMSO]}
其中 TPDRUG 为药物处理组中目标群体的比例,TPDMSO 为对照组比例。
- 分数为 1 表示药物能最强烈、特异性地清除目标细胞; - 分数为 0 表示药物无差异作用; - 分数为负值则说明药物对非肿瘤细胞毒性更强。
为了更精确地识别细胞凋亡状态,研究人员基于 cleaved-CASP3 染色结果,收集了超过 6000 张单细胞图像,并手动标注为阳性或阴性。随后利用改进版 AlexNet 卷积神经网络(CNN)进行训练和分类。网络采用明场图像和 DAPI 双通道输入,最终实现了对细胞凋亡状态的自动识别和大规模定量。
PCY 成像方法的优势在于:
这种成像与分析体系为精准筛选药物候选物提供了可靠工具,也为患者分层和个体化治疗提供了新的实验学依据。
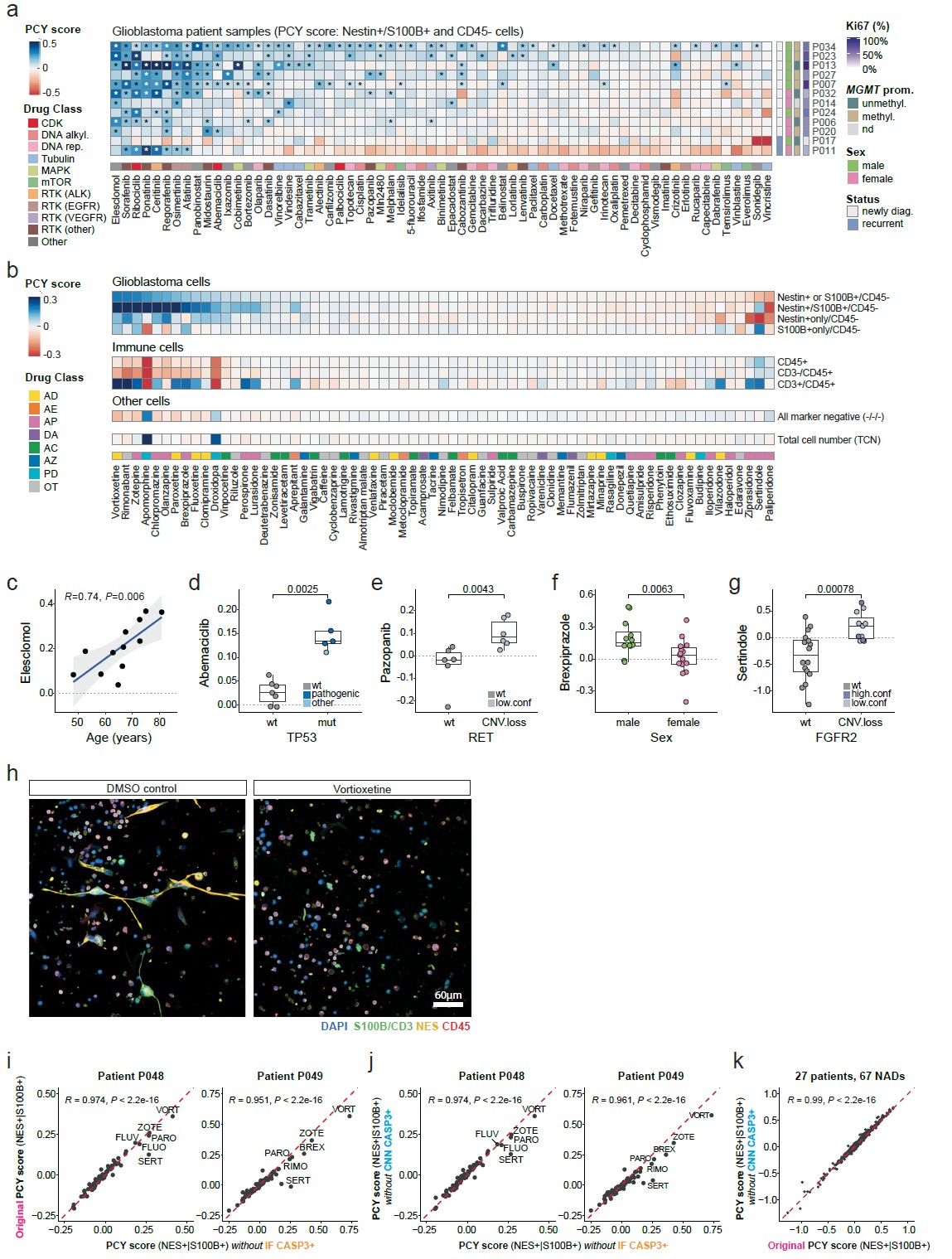
(a) 肿瘤药物(ONCDs, n=65)在 12 位患者样本中的 PCY 评分热图;
(b) 神经活性药物(NADs, n=67)在 27 位患者样本中的 PCY 评分热图,展示各类细胞群的平均响应;
(c-g) 不同临床与遗传参数(年龄、TP53 状态、RET 状态、性别、FGFR2 状态)与药物敏感性的相关性分析;
(h) 患者样本 P025 在 DMSO 对照与伏硫西汀处理后的免疫荧光图像(比例尺 60 μm);
(i-k) 比较原始 NAD PCY 评分与排除凋亡细胞(IF 或 CNN 方法定义 CASP3+)后的评分一致性,验证评分的稳健性。
这项研究具有里程碑意义: 它首次在 临床来源的患者样本上系统性评估 NADs 的抗肿瘤潜力,而不仅是传统癌症药物库。 发现了一个 肿瘤内在的神经脆弱性:Ca²⁺ 驱动的 AP-1/BTG 通路,可以作为新的治疗切入点。 通过 药物再利用(drug repurposing) 思路,研究者证明常见的神经精神科用药有可能成为脑肿瘤治疗新工具,大幅缩短从实验室到临床的时间成本。 未来伏硫西汀等 NADs 可与现有标准疗法(如 TMZ)联用,提升患者预后。
本文提供了一个可操作的框架:通过高通量 ex vivo 平台、跨模态验证和机器学习分析,系统识别并验证了 NADs 的抗 GBM 活性。其核心发现是:抗抑郁药伏硫西汀通过 Ca²⁺ 驱动的 AP-1/BTG 通路抑制胶质母细胞瘤生长,并在小鼠模型中表现出与标准化疗的协同效应。这不仅为胶质母细胞瘤治疗开辟了新的思路,也为药物再利用提供了坚实范例。
Lee S, Weiss T, Bühler M, et al. High-throughput identification of repurposable neuroactive drugs with potent anti-glioblastoma activity. Nature Medicine. 2024;30:3196–3208. doi:10.1038/s41591-024-03224-y